3.3.1 การเกิดพันธะโคเวเลนต์
พันธะโคเวเลนต์ เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่ หรือมากกว่า 1 คู่ก็ได้
- อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
- อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่าอะตอมคู่ร่วมพันธะ
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะเดี่ยวเช่น ในโมเลกุลของไฮโดรเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะคู่เช่น ในโมเลกุลของออกซิเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะสามเช่น ในโมเลกุลของไนโตรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนต์คือ BeCl2เป็นต้น
3.3.2 สูตรโมเลกุลและชื่อของสารโคเวเลนต์
- ถ้าประกอบด้วยธาตุชนิดเดียว เรียกชื่อตามธาตุนั้นโดยระบุสถานะด้วย ซึ่งส่วนใหญ่มีสถานะเป็นแก๊สที่อุณหภูมิห้อง
- ถ้าประกอบด้วยธาตุ 2 ชนิด เรียกตามลำดับที่ปรากฏในสูตรโมเลกุลโดยเปลี่ยนพยางค์หลังเป็นเสียง ไ-ด์ (-ide) และระบุจำนวนอะตอมธาตุองค์ประกอบในโมเลกุลด้วยคำในภาษากรีกตามตาราง
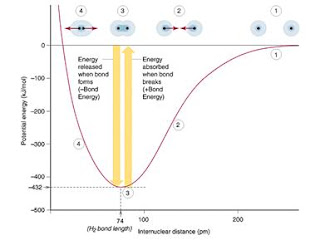
3.3.3 ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
3.3.4 รูปร่างโมเลกุลโคเวเลนต์
3.3.5 สภาพขั้วของโมเลกุลโคเวเลนต์
3.3.6 แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารโคเวเลนต์
- แรงแผ่กระจายลอนดอน เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลไม่มีขั้วหรืออะตอมแก๊สโมเลกุลเป็นแรงอ่อนๆ โดยแรงจะเพิ่มขึ้นตามขนาดของโมเลกุล
- แรงระหว่างขั้ว เกิดจากสภาพขั้วโมเลกุลโดยโมเลกุลที่อยู่ใกล้กันจะหันส่วนของโมเลกุลที่มีขั้วตรงข้ามกันเข้าหากันเกิดเป็นแรงดึงดูดทางไฟฟ้าจากสภาพขั้ว โดยทั่วไปแรงนี้จะเพิ่มขึ้นตามสภาพขั้วของโมเลกุลที่มีขนาดใกล้เคียงกัน
- พันธะไฮโดรเจน










ไม่มีความคิดเห็น:
แสดงความคิดเห็น